Les enzymes sont essentielles au bon fonctionnement de tous les organismes vivants sur Terre. Ils participent à la plupart, sinon à tous, des changements chimiques de la nature, c'est-à-dire à des millions de réactions à la fois dans le monde végétal et dans le monde animal. Il vaut la peine de découvrir ce que sont les enzymes, comment elles fonctionnent et quelle est leur signification pour la médecine moderne.
Table des matières
- Enzymes: Structure
- Régulation de l'activité enzymatique
- Enzymes: rôle
- Enzymes: Nomenclature
- Enzymes et médecine
- Maladies résultant d'enzymes dysfonctionnelles
- Enzymes: utilisation dans le diagnostic
- Enzymes et traitement
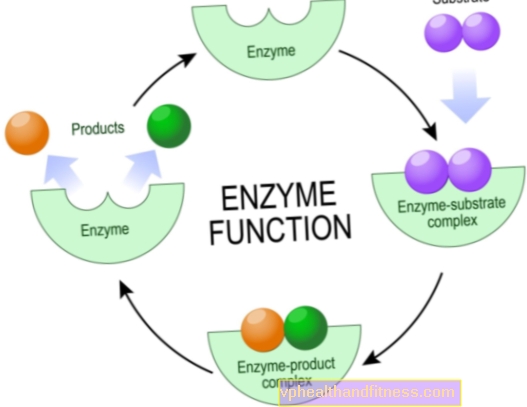
Les enzymes sont des molécules de protéines qui accélèrent ou même permettent à diverses réactions chimiques de se produire dans les organismes vivants, y compris le corps humain.
D'un point de vue chimique, ce sont des catalyseurs, c'est-à-dire des particules qui intensifient la réaction, mais qui ne s'usent pas pendant la réaction. Cette augmentation de l'efficacité des transformations chimiques est souvent énorme, les catalyseurs naturels peuvent raccourcir le temps de réaction de plusieurs années à plusieurs secondes.
Les enzymes se retrouvent dans toutes les zones du corps: dans les cellules, dans l'espace extracellulaire, dans les tissus, dans les organes et à leur lumière, les catalyseurs que produit un tissu donné déterminent ses propriétés spécifiques et le rôle qu'il joue dans l'organisme.
La plupart des enzymes sont très spécifiques, ce qui signifie que chacune d'elles est responsable d'un seul type de réaction chimique dans laquelle des particules spécifiques - les substrats, sont impliquées, et elles seules peuvent interagir avec une enzyme donnée.
L'activité des catalyseurs naturels dépend de nombreux facteurs: l'environnement de réaction, par exemple la température, le pH, la présence de certains ions, les activateurs - ils renforcent l'action des enzymes et des inhibiteurs qui neutralisent cette activité.
Enzymes: Structure
Comme mentionné, la plupart des enzymes sont des protéines, elles ont une structure très diverse: de plusieurs dizaines d'acides aminés à plusieurs milliers, disposés dans une structure spatiale diversifiée.
C'est la forme de leur formation (la structure dite quaternaire) et le fait que la plupart des enzymes soient beaucoup plus grosses que les réactifs de leurs réactions est en grande partie responsable de leur activité.
Cela est dû au fait que seule une certaine région de la structure des enzymes est le site dit actif, c'est-à-dire le fragment responsable de la réalisation de la réaction.
La tâche des fragments restants de la molécule est de fixer un substrat spécifique, moins souvent d'autres composés influençant l'activité de l'enzyme.
Il est intéressant de savoir que la structure du catalyseur est conçue pour que le substrat de jonction soit idéalement adapté en termes de "clé de la serrure".
Comme toutes les protéines, les enzymes sont produites dans les ribosomes à partir du matériel génétique qui est étroitement emballé dans le noyau - l'ADN, créant ainsi une structure dite primaire.
Ensuite, il subit plusieurs plis - changeant de forme, ajoutant parfois des sucres, des ions métalliques ou des résidus gras.
Le résultat de tous ces processus est la formation d'une structure quaternaire active, c'est-à-dire une forme entièrement biologiquement active.
Dans de nombreux cas, plusieurs particules enzymatiques se combinent pour effectuer une série de réactions chimiques et ainsi accélérer le processus.
Il arrive que dans plusieurs tissus, il y ait des enzymes qui catalysent la même réaction, mais structurellement elles ne sont pas toujours similaires les unes aux autres, nous les appelons des isoenzymes.
Les noms des isoenzymes sont les mêmes, malgré la différence de localisation et de structure, mais ces différences ont une application pratique. Ainsi, il est possible de déterminer dans des tests de laboratoire uniquement les fractions enzymatiques provenant d'un organe spécifique.
Les mécanismes d'action des enzymes sont divers, mais d'un point de vue chimique, leur tâche est toujours de réduire l'énergie d'activation de la réaction. C'est la quantité d'énergie que les substrats doivent avoir pour que le processus se déroule.
Cet effet peut être obtenu en créant un environnement approprié pour effectuer la réaction, en utilisant une voie chimique différente pour obtenir les mêmes produits, ou une disposition spatiale appropriée des substrats.
Chacun de ces mécanismes peut être utilisé par des enzymes.
Régulation de l'activité enzymatique
L'action des enzymes dépend de paramètres environnementaux: température, pH et autres. Chacun des catalyseurs naturels a ses propres performances optimales dans certaines conditions, qui peuvent être largement différentes en fonction de sa tolérance aux conditions environnementales.
Dans le cas de la température, la plupart des réactions enzymatiques se déroulent plus rapidement à des températures plus élevées, mais à une certaine température, l'efficacité de la réaction diminue fortement, ce qui est causé par des dommages thermiques à l'enzyme (dénaturation).
En termes de structure, les hormones peuvent être divisées en deux groupes:
- simple - ce ne sont que des particules de protéines
- complexe - qui nécessitent l'attachement d'un groupe non protéique - un cofacteur à leur activité
Ces derniers jouent un rôle clé dans la bonne activité et la régulation des enzymes.
À leur tour, les cofacteurs peuvent être divisés en deux groupes: ceux nécessaires au fonctionnement de l'enzyme, fortement associés à celle-ci - ce sont les groupes dits prothétiques, ils peuvent être des métaux, des molécules organiques, telles que, par exemple, l'hème.
Le deuxième groupe sont les coenzymes, ils sont généralement responsables du transfert de substrats ou d'électrons, et leur liaison à l'enzyme est faible, ce groupe comprend, par exemple, l'acide folique, la coenzyme A. Il convient de savoir que de nombreuses vitamines agissent comme des cofacteurs.
Les inhibiteurs accomplissent une tâche complètement différente, ce sont des particules qui inhibent l'activité enzymatique en se liant à l'enzyme.
Il existe plusieurs types d'inhibiteurs:
- irréversible - ils provoquent une inactivation permanente de la molécule et la réaction ne peut avoir lieu qu'après la production d'une nouvelle enzyme
- compétitif - dans ce cas, l'inhibiteur a une structure similaire au substrat, de sorte qu'ils sont en compétition pour le site actif. Si un inhibiteur est attaché, la réaction échoue tant que le substrat est normal
- non compétitif - ces inhibiteurs se lient à l'enzyme dans un endroit autre que le substrat se fixe, de sorte qu'il peut se fixer à l'enzyme, mais la réaction n'a pas lieu
A une concentration beaucoup plus élevée du substrat que l'inhibiteur, l'effet de l'inhibiteur compétitif est surmonté car il dépasse la «compétition» pour le site actif, dans le cas de non compétitif, son effet ne peut être surmonté en augmentant la concentration du substrat.
En plus de la régulation des systèmes activateurs et inhibiteurs, il existe de nombreuses autres méthodes de contrôle de l'activité enzymatique.
Ils concernent le contrôle de la production cellulaire au niveau de la formation des protéines, ainsi que la régulation du processus dit post-traductionnel, c'est-à-dire des modifications de la structure d'une molécule protéique survenant immédiatement après sa synthèse dans le ribosome. Ces modifications sont, par exemple, le raccourcissement de la chaîne polypeptidique.
D'autres méthodes de régulation concernent la ségrégation et le placement des enzymes dans des zones appropriées: cellulaires et dans des organites spécifiques, ou dans le compartiment extracellulaire.
Il existe un autre mécanisme de régulation important - la rétroaction négative - c'est le principal système de contrôle du système endocrinien. Cela fonctionne sur le principe de l'inhibition.
Cela signifie que si une enzyme produit trop d'une certaine hormone, elle se lie à elle, inhibant son activité et réduisant la synthèse, de sorte que le produit de la réaction lui-même inhibe sa production.
Enzymes: rôle
Chaque tissu du corps humain produit un ensemble spécifique d'enzymes, qui définit le rôle de ces cellules dans le fonctionnement du corps. Quelles sont ces enzymes est définie par le code génétique et quelles régions sont actives dans une cellule donnée.
Des milliers de réactions chimiques ont lieu dans le corps humain à tout moment, chacune nécessitant une enzyme spécifique, il serait donc difficile de lister toutes ces particules présentes dans notre corps.
Cependant, il convient de connaître quelques-uns des plus caractéristiques:
- Enzymes digestives - produites par les tissus du système digestif, elles décomposent les aliments en composés simples, car seuls ceux-ci peuvent être absorbés dans le sang. Ce sont des enzymes extracellulaires, elles remplissent donc leur tâche principale en dehors des cellules où elles sont produites. Certaines de ces enzymes se forment sous une forme inactive, appelée proenzymes ou zymogènes, et sont activées dans le tractus gastro-intestinal. Les enzymes digestives comprennent, par exemple, l'amylase, la lipase, la trypsine.
- La myosine est une enzyme présente dans les muscles, elle décompose les molécules d'ATP qui sont des vecteurs d'énergie, grâce auxquelles elle provoque la contraction des fibres musculaires.
- Les peroxydases sont des enzymes oxydantes et des catalases, c'est-à-dire des enzymes réductrices
- L'acétylcholinestérase est une enzyme qui décompose l'acétylcholine, l'un des messagers du système nerveux
- La monoamine oxydase est l'enzyme la plus abondante dans le foie et est responsable de la dégradation de l'adrénaline, de la norépinéphrine et de certains médicaments
- Cytochome oxydase, une enzyme intracellulaire très importante responsable des changements d'énergie
- Le lysozyme, une substance présente par exemple dans les larmes ou la salive qui remplit des fonctions de protection, détruit les agents pathogènes
- L'alcool déshydrogénase, une enzyme dans le foie qui est responsable de la dégradation de l'éthanol
- La phosphatase alcaline, participe à la construction osseuse par les ostéoblastes
Enzymes: Nomenclature
Les noms des enzymes sont souvent assez compliqués car ils sont dérivés du nom de la réaction qu'ils effectuent et du substrat impliqué dans la réaction, par exemple la 5-hydroxytryptophane décarboxylase.
Typiquement, le suffixe "-aza" est ajouté au nom général de la réaction, et la seconde partie du nom de l'enzyme est formée par le nom du composé subissant cette réaction.
Il arrive que le nom soit unique, alors il provient d'un substrat, par exemple la lactase (enzyme qui décompose le lactose).
Plus rarement, les noms des enzymes dérivent d'un processus général se déroulant avec leur participation, par exemple l'ADN gyrase, c'est-à-dire l'enzyme responsable de la rotation des brins d'ADN.
Certaines enzymes ont finalement des noms communs ou des noms donnés par leur découvreur, comme la pepsine (qui décompose les protéines du tube digestif) ou le lysozyme (une enzyme bactéricide contenue dans les larmes).
Il existe également un petit groupe d'enzymes de restriction responsables de la coupure des brins d'ADN, dans ce cas, le nom vient du micro-organisme à partir duquel l'enzyme a été isolée.
L'Union internationale de biochimie et de biologie moléculaire a introduit les règles de dénomination des enzymes et les a divisées en plusieurs classes afin de standardiser la nomenclature.
Il n'a pas remplacé les noms décrits précédemment, c'est plutôt un supplément utilisé principalement par les scientifiques.
Selon les règles de l'Union européenne, chaque enzyme est décrite par une séquence de caractères: EC x.xx.xx.xx - où le premier chiffre représente la classe, les sous-classes et sous-classes suivantes, et enfin le numéro de l'enzyme. Les classes d'enzymes mentionnées sont:
• 1 - oxydoréductases: catalysent les réactions d'oxydation et de réduction
• 2 - transférases: transfert de groupes fonctionnels (par exemple phosphate)
• 3 - hydrolases: correspondent à l'hydrolyse (décomposition) des liaisons
• 4 - lyases: rompre les liaisons selon un mécanisme différent de l'hydrolyse
• 5 - isomérases: elles sont responsables des changements spatiaux des molécules
• 6 - ligases: connecter des molécules avec des liaisons covalentes
Enzymes et médecine
L'importance des enzymes pour la santé humaine est énorme. Leur bon fonctionnement permet une vie saine, et grâce au développement d'appareils d'analyse, nous avons appris à diagnostiquer diverses maladies au moyen de la détermination enzymatique. De plus, nous sommes en mesure de traiter avec succès les carences de certaines enzymes et les maladies qui en résultent, mais malheureusement, il reste encore beaucoup à faire dans ce domaine.
Le traitement des causes des maladies métaboliques n'est actuellement pas possible, car nous sommes incapables de modifier en toute sécurité et efficacement le matériel génétique afin de réparer les gènes endommagés, et donc les enzymes mal produites.
Maladies résultant d'enzymes dysfonctionnelles
Le bon fonctionnement de notre corps dépend en grande partie du bon fonctionnement des enzymes. Dans de nombreux cas, les états pathologiques affectent la quantité d'enzymes, provoquant leur libération excessive des cellules ou, au contraire, leur carence.Ce qui suit ne sont que des exemples de maladies causées par des fonctions enzymatiques anormales, il y en a beaucoup plus.
- Blocs métaboliques ou maladies métaboliques
Les blocs métaboliques ou les maladies métaboliques sont un groupe de maladies héréditaires causées par l'accumulation de substances dans la cellule en raison de l'absence d'une enzyme responsable de leur métabolisme. Il y a tellement de substrats accumulés au fil du temps qu'ils deviennent toxiques pour les cellules et tout l'organisme.
Ces maladies sont plusieurs milliers, leur nombre reflète la multitude d'enzymes présentes dans le corps humain, car les maladies métaboliques peuvent affecter la plupart des gènes codant les enzymes.
Des exemples sont la galactosémie ou l'homocystinurie, qui sont des maladies rares qui se manifestent le plus souvent immédiatement après la naissance ou dans les premières années de la vie.
- Les tumeurs
Un autre groupe de maladies dans lequel un dysfonctionnement enzymatique peut être impliqué est le cancer. En plus de nombreuses autres fonctions, les enzymes sont également responsables de la régulation de la division cellulaire, appelées tyrosine kinases. Si ces enzymes échouent dans cette zone, une division cellulaire incontrôlée et donc un processus néoplasique peuvent se produire.
- Emphysème
Une maladie moins courante est l'emphysème, auquel cas l'élastase devient hyperactive. C'est une enzyme présente dans le tissu pulmonaire, responsable de la dégradation de la protéine élastine présente dans les poumons, entre autres.
S'il est trop actif, l'équilibre entre la destruction et la construction est perturbé, des cicatrices se produisent et l'emphysème se développe.
Enzymes: utilisation dans le diagnostic
Le diagnostic médical moderne est basé sur l'utilisation d'enzymes dans leurs déterminations. Cela est dû au fait que les états pathologiques entraînent directement ou indirectement un déséquilibre des enzymes, entraînant une augmentation ou une diminution de leur quantité dans le sang.
Cela peut résulter non seulement de troubles de la production, mais également, par exemple, de la libération d'une grande quantité d'enzyme intracellulaire dans le sang ou l'urine en raison d'une lésion de sa membrane cellulaire.
Des exemples d'enzymes utilisées dans les tests de laboratoire sont:
- Créatine kinase - une enzyme présente dans les muscles, également dans le muscle cardiaque, son augmentation multiple peut indiquer une crise cardiaque, une myocardite, des maladies musculaires - des blessures, une dystrophie.
- Lactate déshydrogénase - présente dans toutes les cellules du corps, en particulier dans le cerveau, les poumons, les globules blancs et les muscles. Sa forte augmentation est observée dans les infarctus du myocarde, les maladies musculaires et hépatiques ou le cancer.
- La phosphatase alcaline se trouve principalement dans le foie et les os, ici elle est libérée par les ostéoblastes. Les maladies de ces organes peuvent provoquer sa croissance, mais l'excès de phosphatase alcaline peut également indiquer le processus de régénération des os - après une chirurgie ou une fracture.
- La phosphatase acide se produit dans de nombreux organes - foie, reins, os, prostate, du point de vue diagnostique, son augmentation peut indiquer des maladies des os et de la prostate.
- L'aspartate aminotransférase et l'alanine aminotransférase - ce sont des enzymes caractéristiques du foie, présentes presque exclusivement dans les hépatocytes, elles sont utilisées dans le diagnostic de dépistage de base des maladies du foie et leurs valeurs multipliées par plusieurs incitent toujours à un diagnostic plus approfondi des maladies du foie.
- Glutamate déshydrogénase et gammaglutamyltransférase - d'autres enzymes hépatiques, similaires à celles mentionnées précédemment, sont importantes dans le diagnostic des maladies de cet organe et des voies biliaires.
- L'amylase est une enzyme présente dans de nombreux organes, mais la concentration la plus élevée est atteinte dans les cellules du pancréas et des glandes salivaires, son diagnostic est de la plus grande importance dans leurs maladies.
- La lipase est une autre enzyme pancréatique, sa spécificité diffère de celle de l'amylase, ce qui signifie que la lipase ne se produit que dans le pancréas et que les écarts par rapport à la norme dans la détermination de cette enzyme indiquent une maladie pancréatique.
- La cholinestérase est une enzyme qui décompose l'acétylcholine - un transmetteur dans le système nerveux, où elle est également présente en plus grande quantité, dans les diagnostics, elle est utilisée dans l'empoisonnement par des composés organophosphorés.
- Facteurs de coagulation et de fibrinolyse - ce sont des substances produites par le foie impliquées dans la coagulation du sang, leurs déterminations sont importantes non seulement dans l'évaluation de ce processus, mais également dans la surveillance de la fonction hépatique.
- Alpha-foetoprotéine - une enzyme hépatique, dont la quantité augmente dans les maladies de cet organe, y compris le cancer.
- Protéine C-réactive - produite par le foie, participant à la réponse immunitaire, sa quantité augmente dans le sang dans les conditions inflammatoires - infections, blessures, maladies auto-immunes.
- Céruloplasmine - une autre enzyme hépatique, dont une augmentation est caractéristique de la maladie de Wilson.
- La pyridinoline et la désoxypyridinoline sont des marqueurs de la résorption osseuse (destruction) et caractérisent la fonction des ostéoclastes (cellules ostéogéniques).
- Myoglobine - comme mentionné précédemment, il s'agit d'un composé caractéristique des muscles, de sorte que son augmentation indiquera des dommages aux muscles squelettiques ou cardiaques.
- Les troponines - les soi-disant marqueurs de crise cardiaque, sont des enzymes qui régulent la contraction des fibres musculaires, elles sont particulièrement abondantes dans le muscle cardiaque. Ses dommages provoquent la libération de grandes quantités de troponines dans le sang, qui sont utilisées dans le diagnostic des maladies cardiaques. Cependant, il convient de rappeler qu'une augmentation des troponines peut indiquer non seulement une crise cardiaque, mais aussi son insuffisance, des anomalies valvulaires ou une embolie pulmonaire.
Toutes les enzymes énumérées ci-dessus peuvent être classées en plusieurs groupes:
- Enzymes sécrétoires - la limite inférieure de la norme est le diagnostic. Ce sont des enzymes qui sont produites physiologiquement par les organes, mais dans le cas de maladies, leur nombre diminue, par exemple les facteurs de coagulation
- Indicateurs d'enzymes - la croissance est importante. Ce groupe d'enzymes apparaît en grandes quantités en raison de lésions d'organes et de fuites d'enzymes, ils comprennent par exemple les troponines
- enzymes excrétrices - ce sont des enzymes produites normalement dans la lumière de divers organes - la bouche, les intestins et les voies urinaires. Si leur sortie est bloquée, ils pénètrent dans le sang, par exemple l'amylase
Il convient de rappeler que les enzymes sont utilisées dans le diagnostic médical lui-même. Les analyses biochimiques sont effectuées à l'aide d'enzymes et une interprétation appropriée des résultats des réactions enzymatiques permet de fournir le résultat d'un test de laboratoire.
Enzymes et traitement
De nombreux médicaments agissent en influençant l'action des enzymes, soit en les faisant agir, soit, au contraire, en étant des inhibiteurs. Il existe des substituts enzymatiques tels que la pancréatine contenant de la lipase et de l'amylase pour l'insuffisance pancréatique.
D'autre part, certains groupes de médicaments inhibent l'action des enzymes, par exemple les inhibiteurs de l'enzyme de conversion de l'angiotensine, utilisés, entre autres, dans l'hypertension et l'insuffisance cardiaque, ou certains antibiotiques, par exemple l'amoxicilline, qui inhibe l'enzyme transpeptidase bactérienne, qui empêche la construction de la paroi cellulaire bactérienne, et inhibe ainsi infection.
Certains poisons agissent également en affectant les enzymes. Le cyanure est un puissant inhibiteur de la cytochrome oxydase, un composant essentiel de la chaîne respiratoire. Le bloquer empêche la cellule d'obtenir de l'énergie, ce qui entraîne sa mort.
Pour le bon déroulement des processus de vie des cellules, il est nécessaire de la présence de nombreuses substances chimiques, restant dans des proportions strictes entre elles et entre lesquelles des réactions chimiques se produisent constamment.
Cette tâche est effectuée par des enzymes fonctionnant correctement, qui sont nécessaires pour que presque toute réaction chimique se produise avec la vitesse et l'efficacité nécessaires au bon fonctionnement du corps humain.
L'action des enzymes accélère ces processus plusieurs fois, souvent même des centaines de fois, ce qui est important, les enzymes elles-mêmes ne s'usent pas au cours des réactions en cours.
Le manque de catalyseurs ou leur fonctionnement inapproprié peut entraîner l'émergence de nombreuses maladies. D'autre part, une modification habile de leur activité vous permet de traiter avec succès de nombreuses affections.
L'enzymologie (la science des enzymes) est extrêmement étendue et son développement peut non seulement apporter des progrès scientifiques, mais également contribuer activement au développement de la médecine en termes non seulement de traitement, mais aussi de diagnostic.
A propos de l'auteur

.jpg)

---jak-wyglda-co-to-jest-kariotyp.jpg)