Mardi 15 octobre 2013.- La sclérose latérale amyotrophique, une maladie neuromusculaire dégénérative, également connue sous le nom de maladie de Lou Gehrig, et qui est liée à la maladie neuronale motrice subie par le célèbre physicien Stephen Hawking, est une maladie neurodégénérative qui détruit les neurones en charge de contrôler les mouvements musculaires.
Il n'y a pas encore de remède pour la sclérose latérale amyotrophique, qui tue la plupart des patients de trois à cinq ans après l'apparition des premiers symptômes, et c'est une maladie plus courante qu'il n'y paraît: aux États-Unis, environ 5 600 nouveaux cas sont diagnostiqués chaque année.
Une équipe de neuroscientifiques du Massachusetts Institute of Technology (MIT) de Cambridge, aux États-Unis, a trouvé de nouvelles preuves qu'un échec de la réparation de l'ADN endommagé sous-tend l'origine de la sclérose latérale amyotrophique, et peut-être aussi celle d'autres maladies neurodégénératives telles que par exemple la maladie d'Alzheimer.
Ce qui a été découvert dans la nouvelle étude implique que les médicaments qui renforcent la capacité de réparer l'ADN dans les neurones pourraient aider les patients atteints de sclérose latérale amyotrophique, comme le soutient Li-Huei Tsai, directeur du Picower Institute for Learning and Memory, ci-joint au MIT, et co-auteur de l'étude dans laquelle cette conclusion prometteuse a été faite.
Les neurones font partie des cellules du corps humain qui vivent le plus longtemps. Alors que d'autres cellules sont souvent remplacées, en règle générale, beaucoup de nos neurones sont préservés tout au long de notre vie. Par conséquent, les neurones peuvent accumuler beaucoup de dommages à l'ADN et, pour cette raison, ils sont particulièrement vulnérables aux problèmes résultant de ces dommages, surtout si les réparations de l'ADN ne sont pas effectuées correctement pour une raison quelconque.
Notre génome est constamment endommagé et les ruptures des brins d'ADN sont quotidiennes. Heureusement, ce n'est pas un problème grave car nous avons à l'intérieur les machines nécessaires pour les réparer. Mais si ce mécanisme de réparation ne fonctionne pas très bien, les neurones deviennent les cellules les plus endommagées.
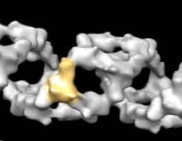
HDAC1 est une enzyme qui régule les gènes en modifiant la chromatine, qui se compose d'ADN enroulé autour d'un noyau central de protéines appelées histones. L'activité normale de HDAC1 fait que l'ADN s'enroule plus étroitement autour des histones, empêchant l'expression des gènes. Cependant, les cellules, y compris les neurones, exploitent également la capacité de HDAC1 à resserrer la chromatine pour stabiliser les brins d'ADN cassés et favoriser la réparation.
HDAC1 travaille en coopération avec une enzyme appelée sirtuin 1 (SIRT1) pour réparer l'ADN et empêcher l'accumulation de dommages qui pourraient être un déclencheur de la neurodégénérescence.
Lorsqu'un neurone subit des ruptures double brin, le SIRT1 migre en quelques secondes vers les sites endommagés, où il recrute le HDAC1 et d'autres facteurs de réparation très rapidement. SIRT1 stimule également l'activité enzymatique de HDAC1, aidant à briser les extrémités cassées de l'ADN.
SIRT1 a récemment gagné en visibilité en tant que protéine qui favorise la longévité et offre une protection contre les maladies, notamment le diabète et la maladie d'Alzheimer. Le groupe Tsai estime que le rôle de cette protéine dans la réparation de l'ADN contribue de manière significative à ces effets bénéfiques.
Dans une tentative d'identifier plus de substances qui fonctionnent aux côtés de HDAC1 dans la réparation de l'ADN, Tsai et ses collègues ont concentré leur attention sur une protéine appelée FUS (Fused In Sarcoma). Le gène FUS correspondant est dans l'une des positions les plus courantes pour les mutations qui provoquent des formes héréditaires de sclérose latérale amyotrophique.
L'équipe de Tsai, Wen-Yuan Wang et Ling Pan, a constaté que le FUS apparaît rapidement sur les lieux lorsque l'ADN est endommagé, suggérant que le FUS orchestre la réponse réparatrice. L'une de ses fonctions est de recruter HDAC1 pour agir sur le site où l'ADN a été endommagé. Sans cela, le HDAC1 n'apparaît pas et la réparation nécessaire n'est pas effectuée. Tsai pense que le FUS pourrait également être impliqué dans la détection rapide des dommages à l'ADN.
Au moins 50 mutations ont été trouvées dans le gène FUS qui provoquent la sclérose latérale amyotrophique. La plupart de ces mutations ont lieu dans deux sections de la protéine FUS. L'équipe du MIT a cartographié les interactions entre FUS et HDAC1 et a constaté que ces deux sections de FUS sont liées à HDAC1.
Les résultats de cette recherche suggèrent que les médicaments qui favorisent la réparation de l'ADN, y compris les activateurs de HDAC1 et SIRT1, pourraient aider à combattre les effets de la sclérose latérale amyotrophique. Un groupe prometteur d'activateurs de SIRT1 est déjà dans une phase de conception très avancée et il a commencé à être testé dans des essais cliniques en vue de son éventuelle utilisation future dans le traitement du diabète.
Source:
Étiquettes:
Nutrition Bien-être Famille
Il n'y a pas encore de remède pour la sclérose latérale amyotrophique, qui tue la plupart des patients de trois à cinq ans après l'apparition des premiers symptômes, et c'est une maladie plus courante qu'il n'y paraît: aux États-Unis, environ 5 600 nouveaux cas sont diagnostiqués chaque année.
Une équipe de neuroscientifiques du Massachusetts Institute of Technology (MIT) de Cambridge, aux États-Unis, a trouvé de nouvelles preuves qu'un échec de la réparation de l'ADN endommagé sous-tend l'origine de la sclérose latérale amyotrophique, et peut-être aussi celle d'autres maladies neurodégénératives telles que par exemple la maladie d'Alzheimer.
Ce qui a été découvert dans la nouvelle étude implique que les médicaments qui renforcent la capacité de réparer l'ADN dans les neurones pourraient aider les patients atteints de sclérose latérale amyotrophique, comme le soutient Li-Huei Tsai, directeur du Picower Institute for Learning and Memory, ci-joint au MIT, et co-auteur de l'étude dans laquelle cette conclusion prometteuse a été faite.
Les neurones font partie des cellules du corps humain qui vivent le plus longtemps. Alors que d'autres cellules sont souvent remplacées, en règle générale, beaucoup de nos neurones sont préservés tout au long de notre vie. Par conséquent, les neurones peuvent accumuler beaucoup de dommages à l'ADN et, pour cette raison, ils sont particulièrement vulnérables aux problèmes résultant de ces dommages, surtout si les réparations de l'ADN ne sont pas effectuées correctement pour une raison quelconque.
Notre génome est constamment endommagé et les ruptures des brins d'ADN sont quotidiennes. Heureusement, ce n'est pas un problème grave car nous avons à l'intérieur les machines nécessaires pour les réparer. Mais si ce mécanisme de réparation ne fonctionne pas très bien, les neurones deviennent les cellules les plus endommagées.
HDAC1 est une enzyme qui régule les gènes en modifiant la chromatine, qui se compose d'ADN enroulé autour d'un noyau central de protéines appelées histones. L'activité normale de HDAC1 fait que l'ADN s'enroule plus étroitement autour des histones, empêchant l'expression des gènes. Cependant, les cellules, y compris les neurones, exploitent également la capacité de HDAC1 à resserrer la chromatine pour stabiliser les brins d'ADN cassés et favoriser la réparation.
HDAC1 travaille en coopération avec une enzyme appelée sirtuin 1 (SIRT1) pour réparer l'ADN et empêcher l'accumulation de dommages qui pourraient être un déclencheur de la neurodégénérescence.
Lorsqu'un neurone subit des ruptures double brin, le SIRT1 migre en quelques secondes vers les sites endommagés, où il recrute le HDAC1 et d'autres facteurs de réparation très rapidement. SIRT1 stimule également l'activité enzymatique de HDAC1, aidant à briser les extrémités cassées de l'ADN.
SIRT1 a récemment gagné en visibilité en tant que protéine qui favorise la longévité et offre une protection contre les maladies, notamment le diabète et la maladie d'Alzheimer. Le groupe Tsai estime que le rôle de cette protéine dans la réparation de l'ADN contribue de manière significative à ces effets bénéfiques.
Dans une tentative d'identifier plus de substances qui fonctionnent aux côtés de HDAC1 dans la réparation de l'ADN, Tsai et ses collègues ont concentré leur attention sur une protéine appelée FUS (Fused In Sarcoma). Le gène FUS correspondant est dans l'une des positions les plus courantes pour les mutations qui provoquent des formes héréditaires de sclérose latérale amyotrophique.
L'équipe de Tsai, Wen-Yuan Wang et Ling Pan, a constaté que le FUS apparaît rapidement sur les lieux lorsque l'ADN est endommagé, suggérant que le FUS orchestre la réponse réparatrice. L'une de ses fonctions est de recruter HDAC1 pour agir sur le site où l'ADN a été endommagé. Sans cela, le HDAC1 n'apparaît pas et la réparation nécessaire n'est pas effectuée. Tsai pense que le FUS pourrait également être impliqué dans la détection rapide des dommages à l'ADN.
Au moins 50 mutations ont été trouvées dans le gène FUS qui provoquent la sclérose latérale amyotrophique. La plupart de ces mutations ont lieu dans deux sections de la protéine FUS. L'équipe du MIT a cartographié les interactions entre FUS et HDAC1 et a constaté que ces deux sections de FUS sont liées à HDAC1.
Les résultats de cette recherche suggèrent que les médicaments qui favorisent la réparation de l'ADN, y compris les activateurs de HDAC1 et SIRT1, pourraient aider à combattre les effets de la sclérose latérale amyotrophique. Un groupe prometteur d'activateurs de SIRT1 est déjà dans une phase de conception très avancée et il a commencé à être testé dans des essais cliniques en vue de son éventuelle utilisation future dans le traitement du diabète.
Source: