1 ml de solution contient 0,9 mg de bromfénac sous forme de sesquihydrate de sodium. La préparation contient du chlorure de benzalkonium.
| Nom | Contenu de l'emballage | La substance active | Prix 100% | Dernière modification |
| Yellox | chaussure. 5 ml, collyre, solution. | Bromfénac | 30 PLN | 2019-04-05 |
action
Anti-inflammatoire non stéroïdien (AINS) à usage topique. Il a un effet anti-inflammatoire, probablement en raison de sa capacité à inhiber la synthèse des prostaglandines en inhibant principalement la COX-2. Il y a très peu d'inhibition de COX-1. Le bromfénac traverse la cornée des patients atteints de cataracte. Après une dose unique, la concentration maximale moyenne dans l'humeur aqueuse survient 150 à 180 minutes après l'administration du médicament. Les concentrations ont été maintenues dans l'humeur aqueuse pendant 12 heures, et les niveaux mesurables ont été maintenus pendant jusqu'à 24 heures dans les principaux tissus du globe oculaire, y compris la rétine. Après l'administration de gouttes ophtalmiques de bromfénac deux fois par jour, les concentrations plasmatiques n'étaient pas quantifiables. Le médicament est fortement lié aux protéines plasmatiques (99,8%). Aucune liaison biologiquement pertinente à la mélanine n'a été observée dans les études in vitro. Dans une étude chez le lapin, il a été montré que les concentrations les plus élevées après administration topique étaient observées dans la cornée, suivie de la conjonctive et de l'humeur aqueuse; seules de faibles concentrations ont été observées dans le cristallin et le vitré. Le bromfénac est principalement métabolisé par le CYP2C9, qui ne se trouve ni dans le corps ciliaire pupillaire ni dans la rétine / choroïde, et l'activité de cette enzyme dans la cornée est inférieure à 1% par rapport à celle du foie. Après administration oculaire de bromfénac, sa T0,5 dans l'humeur aqueuse est de 1,4 h, indiquant une élimination très rapide. L'excrétion urinaire est la principale voie d'élimination du médicament (environ 82%), les fèces excrétant environ 13% de la dose.
Dosage
Adultes, y compris les personnes âgées: 1 goutte dans le ou les yeux traités 2 fois par jour, à compter du lendemain de la chirurgie de la cataracte. Le médicament doit être utilisé pendant les 2 premières semaines de la période postopératoire. Le traitement ne doit pas dépasser 2 semaines car aucune donnée n'est disponible sur la sécurité d'un traitement plus long. Si plus d'un médicament ophtalmique topique est utilisé, ils doivent être appliqués à des intervalles d'au moins 5 minutes. L'administration chez les patients présentant une maladie hépatique ou une insuffisance rénale n'a pas été étudiée. La sécurité et l'efficacité du bromfénac chez les enfants et les adolescents n'ont pas été établies (aucune donnée n'est disponible).
Les indications
Traitement de l'inflammation oculaire postopératoire après chirurgie de la cataracte chez l'adulte.
Contre-indications
Hypersensibilité au bromfénac, à l'un des excipients ou à d'autres AINS. Le médicament est contre-indiqué chez les patients chez lesquels l'acide acétylsalicylique ou d'autres médicaments inhibant la prostaglandine synthétase provoquent de l'asthme, de l'urticaire ou des crises de rhinite aiguë.
Précautions
Tous les AINS topiques peuvent ralentir ou retarder la guérison, tout comme les corticostéroïdes topiques, l'utilisation concomitante d'AINS et de corticostéroïdes topiques peut potentiellement aggraver les troubles de la guérison. En raison du risque de sensibilité croisée, évitez de traiter les personnes qui ont déjà présenté une hypersensibilité à l'acide acétylsalicylique, aux dérivés de l'acide phénylacétique et à d'autres AINS. Chez les patients prédisposés, l'utilisation topique chronique d'AINS peut entraîner des lésions épithéliales, un amincissement cornéen, des érosions cornéennes, une ulcération cornéenne ou une perforation cornéenne. Ces événements peuvent menacer votre vue. Les patients présentant des lésions connues de l'épithélium cornéen doivent immédiatement interrompre le traitement topique par AINS; l'état de leur cornée doit être surveillé attentivement. Chez les patients à risque, l'utilisation concomitante de corticostéroïdes avec des AINS ophtalmiques peut entraîner un risque accru d'événements indésirables cornéens. Les patients présentant une chirurgie ophtalmique compliquée, une dénervation cornéenne, des lésions épithéliales cornéennes, un diabète sucré et des maladies de la surface oculaire telles que le syndrome de l'œil sec, la polyarthrite rhumatoïde, ou qui ont subi une chirurgie oculaire répétée dans un court laps de temps peuvent présenter un risque accru d'effets secondaires cornéens qui peuvent peut mettre votre vue en danger. Les AINS topiques doivent être utilisés avec prudence chez ces patients. Les AINS ophtalmiques associés à une chirurgie oculaire peuvent provoquer une augmentation des saignements des tissus oculaires (y compris des saignements dans la chambre antérieure de l'œil) - la préparation doit être utilisée avec prudence chez les patients ayant des tendances hémorragiques connues et chez les patients prenant d'autres médicaments susceptibles de prolonger le temps de saignement. Dans de rares cas, il a été observé qu'après l'arrêt de la préparation, la réaction inflammatoire peut s'intensifier après une chirurgie de la cataracte, par exemple sous la forme d'un œdème maculaire. Une infection oculaire aiguë peut être masquée par l'utilisation topique d'anti-inflammatoires. Il n'est généralement pas recommandé de porter des lentilles de contact dans la période postopératoire après une chirurgie de la cataracte - par conséquent, les patients doivent être avisés de ne pas porter de lentilles de contact pendant le traitement avec la préparation. La préparation contient du chlorure de benzalkonium, qui peut provoquer une irritation des yeux, ainsi qu'une kératopathie ponctuelle et / ou une kératopathie ulcéreuse toxique - une surveillance attentive est nécessaire en cas d'utilisation fréquente ou prolongée. La préparation contient du sulfite de sodium, qui peut provoquer des réactions de type allergique chez les patients prédisposés, y compris des symptômes de choc anaphylactique et d'épisodes d'asthme potentiellement mortels ou moins sévères.
Activité indésirable
Peu fréquent: diminution de l'acuité visuelle, rétinopathie hémorragique, perte épithéliale cornéenne (administrée 4 fois par jour), érosion cornéenne (légère ou modérée), trouble épithélial cornéen, œdème cornéen, épanchement rétinien, douleur oculaire, saignement des paupières, vision trouble, photophobie, œdème des paupières, écoulement oculaire, démangeaisons oculaires, irritation oculaire, rougeur oculaire, hyperémie conjonctivale, sensation oculaire anormale, inconfort oculaire, saignements de nez, toux, écoulement sinusal paranasal, gonflement du visage. Rare: perforation cornéenne, ulcération cornéenne, érosion cornéenne - sévère, ramollissement scléral, infiltrats cornéens, troubles cornéens, cicatrices cornéennes, asthme.
Grossesse et allaitement
Il n’existe pas de données suffisantes sur l’utilisation du bromfénac chez la femme enceinte. En raison de l'effet connu des médicaments inhibant la biosynthèse des prostaglandines sur le système cardiovasculaire fœtal (fermeture du canal artériel), la préparation doit être évitée au cours du troisième trimestre de la grossesse. L'utilisation du médicament pendant la grossesse n'est généralement pas recommandée à moins que les avantages l'emportent sur les risques potentiels. On ne sait pas si le bromfénac ou ses métabolites sont excrétés dans le lait maternel. Aucun effet sur les nouveau-nés / nourrissons allaités n'est attendu car l'exposition systémique au bromfénac est minime chez les femmes qui allaitent. La préparation peut être utilisée pendant l'allaitement. Les études chez l'animal n'indiquent pas d'effets nocifs du bromfénac sur la fertilité. De plus, l'exposition systémique au bromfénac est négligeable. Pour cette raison, il n'est pas nécessaire de subir des tests de grossesse et d'utiliser une contraception.
commentaires
Le médicament a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. Après instillation de la préparation, une vision trouble temporaire peut apparaître - ne conduisez pas et n'utilisez pas de machines jusqu'à ce que ces symptômes disparaissent.
Les interactions
Aucune étude d'interaction n'a été réalisée. Aucune interaction n'a été rapportée avec des gouttes ophtalmiques antibiotiques utilisées en conjonction avec une intervention chirurgicale.
Prix
Yellox, prix 100% PLN 30,0
La préparation contient la substance: Bromfénac
Médicament remboursé: NON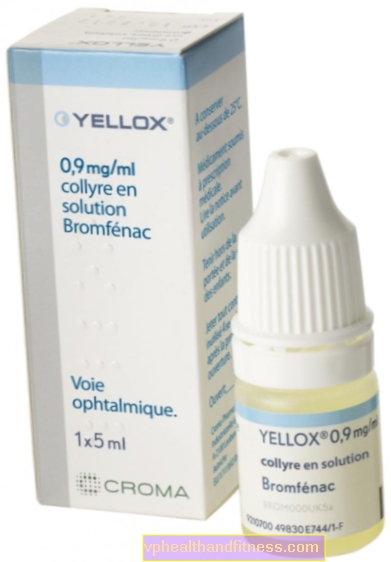












-zagroeniem-dla-ycia-kobiety.jpg)